Exercício Resolvido de Calorimetria
publicidade
Em que proporção deve ser dividida certa massa M de água inicialmente a 20 °C, sob pressão normal, admitindo-se que todo calor retirado da parte que se congela seja usado para evaporar a outra parte? Dados:
Calor específico da água: 1 cal/g °C;
Calor latente de vaporização da água: 540 cal/g;
Calor latente de solidificação da água: −80 cal/g.
Dados do problema:
- Temperatura inicial da água: ti = 20 °C;
- Massa de água: M;
- Calor específico da água: c = 1 cal/g °C;
- Calor latente de vaporização da água: LV = 540 cal/g;
- Calor latente de solidificação da água: LS = – 80 cal/g.
A massa total de água será a soma da parte que congela, mc, com a parte que evapora, mv
\[
\begin{gather}
M=m_{c}+m_{v} \tag{I}
\end{gather}
\]
A parte da água que congela deve ser primeiro resfriada da temperatura inicial de 20 °C até 0 °C, deve ser
retirada uma quantia de calor Q1 (Figura 1), a seguir, mantendo-se a temperatura constante,
a água é congelada retirando-se uma quantia de calor Q2.
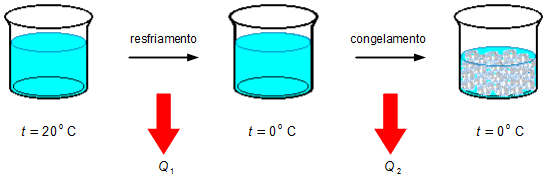
A quantidade de calor retirada no resfriamento é calculada pela expressão do calor sensível
\[
\begin{gather}
\bbox[#99CCFF,10px]
{Q=mc\left(t_{f}-t_{i}\right)} \tag{II}
\end{gather}
\]
onde a temperatura final será tf = 0 °C
\[
\begin{gather}
Q_{1}=m_{c}c\left(t_{f}-t_{i}\right)\\
Q_{1}=m_{c}.1.\left(0-20\right)\\
Q_{1}=-20m_{c} \tag{III}
\end{gather}
\]
o sinal negativo indica que a água está perdendo calor.A quantidade de calor retirada no congelamento é calculada pela expressão do calor latente
\[
\begin{gather}
\bbox[#99CCFF,10px]
{Q=mL} \tag{IV}
\end{gather}
\]
\[
\begin{gather}
Q_{2}=m_{c}L_{S}\\
Q_{2}=m_{c}.(-80)\\
Q_{2}=-80m_{c} \tag{V}
\end{gather}
\]
A parte da água que evapora deve ser primeiro aquecida da temperatura inicial de 20 °C até 100 °C, deve ser
fornecida uma quantia de calor Q3 (Figura 2), a seguir, mantendo-se a temperatura
constante, a água é evaporada fornecendo-se uma quantia de calor Q4.
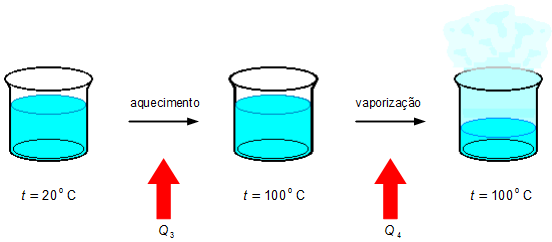
Usando a expressão (II), com a temperatura final tf = 100 °C o calor fornecido para o aquecimento será
\[
\begin{gather}
Q_{3}=m_{v}c\left(t_{f}-t_{i}\right)\\
Q_{3}=m_{v}.1.\left(100-20\right)\\
Q_{3}=-80m_{v} \tag{VI}
\end{gather}
\]
A quantidade de calor fornecida para a evaporação é dada pela expressão (IV)
\[
\begin{gather}
Q_{4}=m_{v}L_{v}\\
Q_{4}=m_{v}.540\\
Q_{4}=540m_{v} \tag{VII}
\end{gather}
\]
O problema nos diz que todo calor retirado da parte que esfria é usado para evaporar a outra parte, o sistema
é isolado e só há troca de calor entre as duas partes de água, como o calor é energia em trânsito podemos
usar a conservação da energia, “a somatória dos calores trocados é igual a zero num sistema termicamente
isolado”
\[ \bbox[#99CCFF,10px]
{\sum Q=0}
\]
\[
\begin{gather}
Q_{1}+Q_{2}+Q_{3}+Q_{4}=0\\
-20m_{c}-80m_{c}+80m_{v}+540m_{v}=0\\
-100m_{c}+620m_{v}=0 \tag{VIII}
\end{gather}
\]
Usando a expressão (I)
\[
\begin{gather}
m_{c}=M-m_{v} \tag{IX}
\end{gather}
\]
substituindo a expressão (IX) na expressão (VIII)
\[
\begin{gather}
-100\left(M-m_{v}\right)+620m_{v}=0\\
-100M+100m_{v}+620m_{v}=0\\
-100M+720m_{v}=0\\
720m_{v}=100M\\
m_{v}=\frac{100}{720}M
\end{gather}
\]
\[ \bbox[#FFCCCC,10px]
{m_{v}=0,139M}
\]
Substituindo este valor na expressão (IX)
\[
m_{c}=M-0,139M
\]
\[ \bbox[#FFCCCC,10px]
{m_{c}=0,861M}
\]
Observação: Da expressão (VIII) também poderíamos escrever
\[
\begin{gather}
620m_{v}=100m_{c}\\
\frac{m_{v}}{m_{c}}=\frac{100}{620}\\
\frac{m_{v}}{m_{c}}=\frac{5}{31}
\end{gather}
\]
Este resultado significa que para cada 5 partes de água que evapora temos 31 partes de água que congela.
publicidade

Fisicaexe - Exercícios Resolvidos de Física de Elcio Brandani Mondadori está licenciado com uma Licença Creative Commons - Atribuição-NãoComercial-Compartilha Igual 4.0 Internacional .