Exercício Resolvido de Calorimetria
publicidade
Determine o calor necessário para transformar 100 g de gelo a −10 °C em 100 g de vapor a 100 °C. Faça também um gráfico da temperatura em função da quantidade de calor das transformações. Dados:
calor específico do gelo: cg = 0,5 cal/g°C;
calor latente de fusão: LF = 80 cal/g;
calor específico da água: ca = 1,0 cal/g°C;
calor latente de vaporização: Lv = 540 cal/g.
Dados do problema:
- Massa de gelo: m = 100 g;
- Temperatura inicial do gelo: ti = −10 °C;
- Temperatura final do vapor: tf = 100 °C;
- Calor específico do gelo: cg = 0,5 cal/g°C;
- Calor latente de fusão: LF = 80 cal/g;
- Calor específico da água: ca = 1,0 cal/g°C;
- Calor latente de vaporização: Lv = 540 cal/g.
- 1.ª Parte

\[
\begin{gather}
\bbox[#99CCFF,10px]
{Q=mc\Delta t} \tag{I}
\end{gather}
\]
\[
\begin{gather}
Q_1=mc_g\Delta t \\[5pt]
Q_1=m c_g(t_0-t_{-10}) \\[5pt]
Q_1=100\times 0,5\times[0-(-10)] \\[5pt]
Q_1=100\times 0,5\times 10 \\[5pt]
Q_1=500\;\mathrm{cal}
\end{gather}
\]
- 2.ª Parte
\[
\begin{gather}
\bbox[#99CCFF,10px]
{Q=mL} \tag{I}
\end{gather}
\]
\[
\begin{gather}
Q_2=mL_F \\[5pt]
Q_2=100\times 80 \\[5pt]
Q_2=8000\;\mathrm{cal}
\end{gather}
\]
- 3.ª Parte

\[
\begin{gather}
Q_3=m c_a\Delta t \\[5pt]
Q_3=m c_a(t_{100}-t_0) \\[5pt]
Q_3=100\times 1,0\times(100-0) \\[5pt]
Q_3=100\times 1,0\times 100 \\[5pt]
Q_3=10000\;\mathrm{cal}
\end{gather}
\]
- 4.ª Parte

\[
\begin{gather}
Q_4=mL_v \\[5pt]
Q_4=100\times 540 \\[5pt]
Q_4=54000\;\mathrm{cal}
\end{gather}
\]
O calor total para transformar 100 g de gelo a −10°C em vapor a 100°C será a soma de todas as
parcelas calculadas acima
\[
\begin{gather}
Q=Q_1+Q_2+Q_3+Q_4 \\[5pt]
Q=500+8000+10000+54000
\end{gather}
\]
\[
\begin{gather}
\bbox[#FFCCCC,10px]
{Q=72500\;\mathrm{cal}}
\end{gather}
\]
Colocando em um gráfico os valores das temperaturas de cada fase das transformações e as quantidades de calor
acumuladas em cada fase temos o gráfico da Figura 5 abaixo
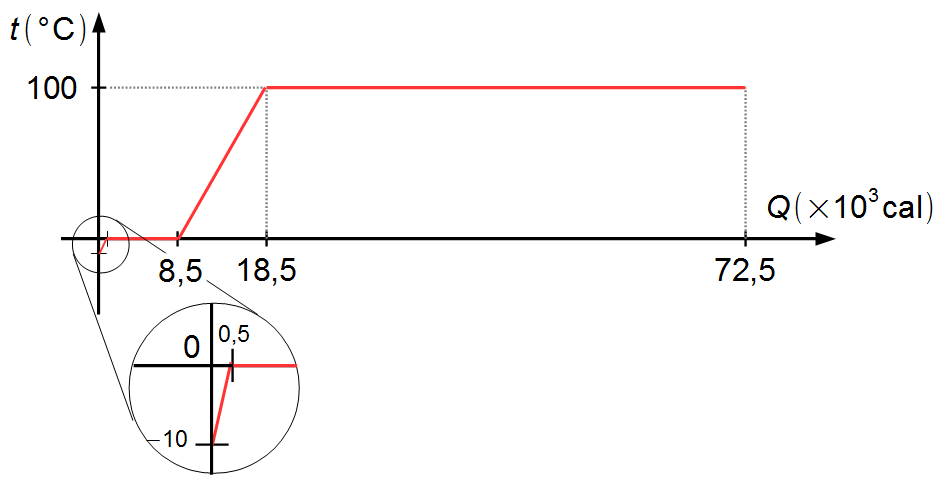
Observação: veja que, feito o gráfico em escala, a quantidade de calor necessária para
esquentar o gelo de −10 °C até 0 °C é representada por uma parte muito pequena (mostrada em destaque),
enquanto a quantidade de calor necessária para vaporizar a água a 100 °C ocupa a maior parte do gráfico.
publicidade

Fisicaexe - Exercícios Resolvidos de Física de Elcio Brandani Mondadori está licenciado com uma Licença Creative Commons - Atribuição-NãoComercial-Compartilha Igual 4.0 Internacional .