Exercício Resolvido de Gases
publicidade
Um gás está inicialmente a uma pressão de 2 atmosferas, volume de 4 litros e temperatura de 300 kelvins. A partir deste estado sua pressão aumenta a volume constante até uma pressão de 5 atmosferas, determine sua temperatura ao final desta transformação. Depois desta primeira transformação ele é expandido à temperatura constante até um volume de 8 litros, determine sua pressão ao final desta segunda transformação. A partir deste ponto o gás é aquecido à pressão constante até uma temperatura de 900 kelvins, determine o volume final do gás. Represente as transformações do gás num gráfico da pressão em função do volume p×V.
Solução
Para as situações inicial e final da primeira transformação
| Estado inicial | Estado final |
|---|---|
| pressão: p0 = 2 atm | pressão: p1 = 5 atm |
| volume: V0 = 4 \( \ell \) | volume: V1 = 4 \( \ell \) |
| temperatura: T0 = 300 K | temperatura: T1 |
Da Lei Geral dos Gases Perfeitos
\[ \bbox[#99CCFF,10px]
{\frac{p_{i}V_{i}}{T_{i}}=\frac{p_{f}V_{f}}{T_{f}}}
\]
Como na transformação dada o volume se mantém constante Vi = Vf, temos uma
transformação
isométrica ou isovolumétrica ou isocórica
e Lei Geral se reduz a Lei de Gay-Lussac
\[ \bbox[#99CCFF,10px]
{\frac{p_{i}}{T_{i}}=\frac{p_{f}}{T_{f}}}
\]
substituindo os dados do problema
\[
\begin{gather}
\frac{2}{300}=\frac{5}{T_{1}}\\
T_{1}=\frac{5.300}{2}\\
T_{1}=5.150
\end{gather}
\]
\[ \bbox[#FFCCCC,10px]
{T_{1}=750\;\text{K}}
\]
Depois da primeira transformação o estado final do gás passa a ser o estado inicial da segunda transformação. Para
as situações inicial e final da segunda transformação
| Estado inicial | Estado final |
|---|---|
| pressão: p1 = 5 atm | pressão: p2 |
| volume: V1 = 4 \( \ell \) | volume: V2 = 8 \( \ell \) |
| temperatura: T1 = 750 K | temperatura: T2 = 750 K |
Como na transformação dada a temperatura se mantém constante (Ti = Tf) uma transformação isotérmica e a Lei Geral se reduz a Lei de Boyle-Mariotte
\[ \bbox[#99CCFF,10px]
{p_{i}V_{i}=p_{f}V_{f}}
\]
substituindo os dados do problema
\[
\begin{gather}
5.4=p_{2}8\\
p_{2}=\frac{20}{8}
\end{gather}
\]
\[ \bbox[#FFCCCC,10px]
{p_{2}=2,5\;\text{atm}}
\]
Após a segunda transformação o estado final do gás passa a ser o estado inicial da terceira transformação. Para as
situações inicial e final da terceira transformação
| Estado inicial | Estado final |
|---|---|
| pressão: p2 = 2,5 atm | pressão: p3 = 2,5 atm |
| volume: V2 = 8 \( \ell \) | volume: V3 |
| temperatura: T2 = 750 K | temperatura: T3 = 900 K |
Como na transformação dada a pressão se mantém constante (pi = pf) temos uma transformação isobárica e a Lei Geral se reduz a Lei de Charles
\[ \bbox[#99CCFF,10px]
{\frac{V_{i}}{T_{i}}=\frac{V_{f}}{T_{f}}}
\]
substituindo os dados do problema
\[
\begin{gather}
\frac{8}{750}=\frac{V_{3}}{900}\\
v_{3}=\frac{8.900}{750}
\end{gather}
\]
dividindo o numerador e o denominador por 50
\[
\begin{gather}
v_{3}=\frac{8.900:50}{750:50}\\
v_{3}=\frac{8.18}{15}\\
v_{3}=\frac{144}{15}
\end{gather}
\]
\[ \bbox[#FFCCCC,10px]
{V_{3}=9,6\;\text{l}}
\]
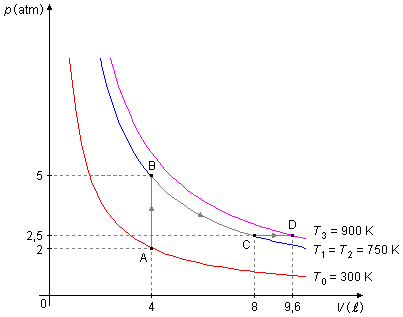
Com os dados obtidos no problema construímos o Gráfico 1, de A para B o gás sofre uma transformação
isométrica ou isovolumétrica ou isocórica,
de B para C uma transformação
isotérmica
e de C para D uma transformação
isobárica.
publicidade

Fisicaexe - Exercícios Resolvidos de Física de Elcio Brandani Mondadori está licenciado com uma Licença Creative Commons - Atribuição-NãoComercial-Compartilha Igual 4.0 Internacional .